近日,我校物理学系陈虎教授与吴晨旭教授,在蛋白质折叠与去折叠动力学方面取得新的研究进展,发现典型的两态模型蛋白质GB1在折叠去折叠过程中会经过一个不稳定的隐藏中间态,并且在自然状态与这个中间态之间存在两条不同的转变路径。研究成果发表在著名物理学期刊 Physical Review Letters上(Phys. Rev. Lett. (2020) 125, 198101 )。
在传统的实验策略下,对蛋白质施加随时间线性增加的外加拉力,测量并统计蛋白质GB1发生去折叠时的拉力分布,实验结果可以很好地用两态模型来描述。但是这种实验策略得到的蛋白质在小于20 皮牛下发生去折叠转变的样本非常少,不足以揭示蛋白质GB1在小力下真正的去折叠动力学与拉力的依赖关系。
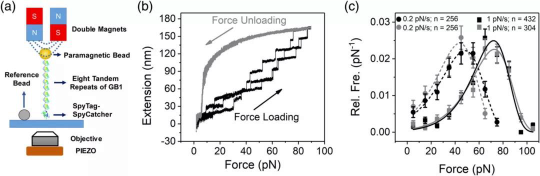
磁镊拉伸蛋白质的装置示意图与恒定加载速率条件下的实验结果。
得益于陈虎教授单分子生物物理实验室自主搭建的单分子磁镊设备优越的稳定性与纳米级别的空间分辨率,博士生郭子龙测量了GB1蛋白质在5-160皮牛的拉力范围内的去折叠速率,在拉力大于15皮牛时得到了与传统实验策略相同的结果,但在小于15皮牛的拉力区间内,发现了GB1去折叠转变复杂的拉力依赖性质。特别是在拉力处于10-14皮牛之间时,拉力的增加非但没有增加去折叠速率,反而使之减小了,表现为局部的catch bond现象。在更小的拉力下,去折叠速率变得对拉力更加敏感,在对数坐标下表现为更陡的斜率。
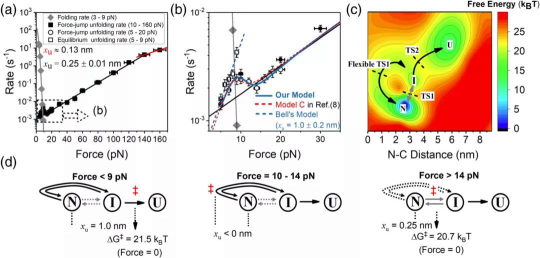
 拉力依赖的蛋白质GB1的折叠与去折叠速率,和据此构造的蛋白质自由能曲面与去折叠的动力学模型。
拉力依赖的蛋白质GB1的折叠与去折叠速率,和据此构造的蛋白质自由能曲面与去折叠的动力学模型。
蛋白质GB1去折叠速率对于拉力的复杂依赖关系使得我们可以分析其自由能曲面和构象转变的路径。我们发现在不同拉力下,蛋白质去折叠会经过不同的路径。模型中确定的不稳定的隐藏中间态很可能就是蛋白质折叠理论模型中假设的塌缩熔融球构象。结合课题组在不同单结构域蛋白质折叠与去折叠动力学研究的一系列工作,本文的发现对于揭示单结构域蛋白质折叠的普遍规律具有重要意义。
文章发表在著名物理学期刊 Physical Review Letters,厦门大学物理系博士生郭子龙是文章第一作者,陈虎和吴晨旭老师为通讯作者,南京大学曹毅教授和王炜教授在样品制备方面和实验设计方面做出重要贡献。

陈虎教授(左一)及吴晨旭教授(右一)指导郭子龙(左二)研究工作
论文链接:
https://journals.aps.org/prl/abstract/10.1103/PhysRevLett.125.198101