先天免疫系统在防止病原生物入侵宿主方面起着重要作用。当病原体侵入机体后,以巨噬细胞为代表的吞噬细胞立即响应,识别并吞噬病原体并调动NADPH氧化酶体和线粒体向吞噬泡内释放大量活性氧簇(ROS)以实现对病原体的杀灭和清除。在此过程中,巨噬细胞如何维持ROS的产生和消除之间的平衡以实现清除病原体的同时还能防止ROS导致自身损伤和衰老就显得尤为关键。

2月14日, 细胞应激生物学国家重点实验室、细胞信号网络协同创新中心、厦门大学生命科学学院陈兰芬教授课题组在《Nature Communications》上发表了题为“Macrophage achieves self-protection against oxidative stress-induced ageing through the Mst-Nrf2 axis”的研究论文,揭示了巨噬细胞中的Hippo激酶Mst1/2能够感应ROS并募集到自吞噬体和线粒体的ROS产生部位并被释放的ROS活化,进而激活抗氧化转录因子Nrf2来维持胞内氧化还原稳态,从而在巨噬细胞对病原体清除期间保护细胞免受氧化损伤导致衰老与死亡的重要机制。
本项研究发现,与野生型巨噬细胞相比,Mst1/2缺失的巨噬细胞的本底ROS水平较高,持续性氧化应激造成DNA损伤和细胞凋亡,而抗氧化剂N-乙酰半胱氨酸(NAC)处理可以显著缓解Mst1/2敲除的巨噬细胞的氧化应激表型。此外,在老年小鼠中,Mst1/2缺失的巨噬细胞更早出现免疫应答功能和抗感染能力下降、胞内脂褐素的积累更为显著以及端粒长度更短等早衰现象,导致巨噬细胞病原清除能力下降,容易造成机体的病原感染。这些结果表明Mst1/2激酶可能在巨噬细胞ROS稳态维持和抗衰老中发挥重要作用。进一步分析氧化应激相关的几个转录因子后,发现与T细胞或B细胞相比,Nrf2在巨噬细胞中高表达,并且与野生型相比, Mst1/2敲除的巨噬细胞中多个Nrf2下游靶基因表达显著降低。深入研究发现Mst1/2缺失的巨噬细胞中Nrf2泛素化水平明显上升,蛋白水平显著降低。利用病毒载体回补Nrf2明显缓解Mst1/2缺失的巨噬细胞内ROS水平、DNA损伤和细胞凋亡比例,证实了在巨噬细胞中抗氧化因子Nrf2是Hippo激酶下游的关键分子。

图1.Mst1/2可以感受ROS并募集到自吞噬体(左边)和线粒体(右边)的ROS产生部位,被释放的ROS激活
该课题组机制研究发现激酶Mst1/2可以感受ROS并募集到自吞噬体和线粒体的ROS产生部位,被释放的ROS激活,活化的Mst1/2调节抗氧化转录因子Nrf2来维持胞内氧化还原稳态,在病原体清除期间保护细胞免受大量杀伤性ROS诱导的氧化损伤。Nrf2受到负性调节蛋白Keap1的精确调控,多聚化的Keap1能通过C端Kelch结构域锚定Nrf2并促使其走向蛋白酶体依赖性降解,从而抑制其转录活性。本项目研究人员观察到Keap1也能够响应大肠杆菌侵染与Mst1/2在大肠杆菌侵染部位形成三者共定位,而这一现象在使用NAC预处理后明显减少。进一步研究还发现Mst1/2激酶可直接结合Keap1,并对Keap1的四个位点的进行磷酸化修饰,Mst1/2介导的Keap1磷酸化阻止了Keap1分子的多聚化,从而阻断了Nrf2的泛素化和蛋白降解。而当Keap1分子中的四个位点突变为Mst1/2激酶持续失活形态的Keap14A时,更易形成多聚化Keap1,增加了Nrf2的泛素化水平和蛋白不稳定性,从而造成细胞氧化损伤。因此本研究揭示了在巨噬细胞参与宿主防御过程中存在的一条新颖的抗氧化和抗衰老信号,阐明了Mst1/2参与调节巨噬细胞维持氧化应激稳态以实现清除病原体的同时还能避免ROS诱导的自身损伤和细胞衰老的关键机制,为进一步研究氧化应激是如何促进衰老相关炎症和感染的发生和发展提供可能的理论基础。
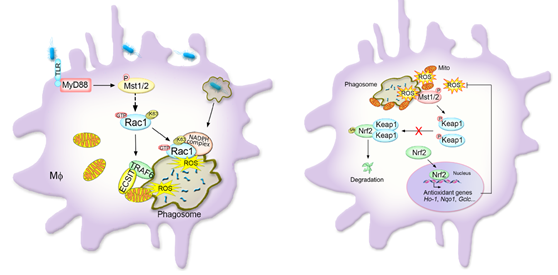
图2. Hippo通路调控巨噬细胞病原杀伤ROS产生及抗氧化衰老中发挥重要作用。
左图:揭示了巨噬细胞内Hippo激酶Mst1/2调控线粒体迁移及促进其向吞噬小泡募集与吞噬体协同产生大量杀伤性ROS,清除病原体的功能和机制 (Nature Immunol, 2015,封面文章) ;右图:发现Hippo激酶Mst1/2能感应胞内ROS并募集到ROS释放的细胞器附近并被活化,进一步激活和稳定抗氧化的关键转录因子Nrf2, 实现巨噬细胞在杀伤病原同时能自身抗氧化损伤与衰老的重要机制 (Nature Commun, 2019) 。
陈兰芬教授团队长期致力于Hippo信号通路在免疫系统中的功能机制研究。该团队于2015年在《Nature Immunology》杂志以封面故事阐明了吞噬性细胞内激酶Mst1/2通过活化Rac家族蛋白来调节线粒体向吞噬小泡募集并释放ROS来清除病原体,这个生物学过程在天然免疫和宿主防御中发挥着重要作用。2017年,该团队再次在《Nature Immunology》杂志以封面故事阐释了Hippo通路转录共激活因子TAZ在决定CD4+初始T细胞分化为促进炎症的TH17效应细胞和抑制免疫反应的Treg调节性细胞过程中发挥着关键作用,揭示了TAZ在调节自身性免疫疾病发生发展中的重要功能。
厦门大学生命科学学院博士生王平和博士后耿晶为论文共同第一作者,通讯作者为陈兰芬教授。该研究工作获得了国家自然科学基金、国家重点基础研究重大专项等资助。
论文链接:https://www.nature.com/articles/s41467-019-08680-6
